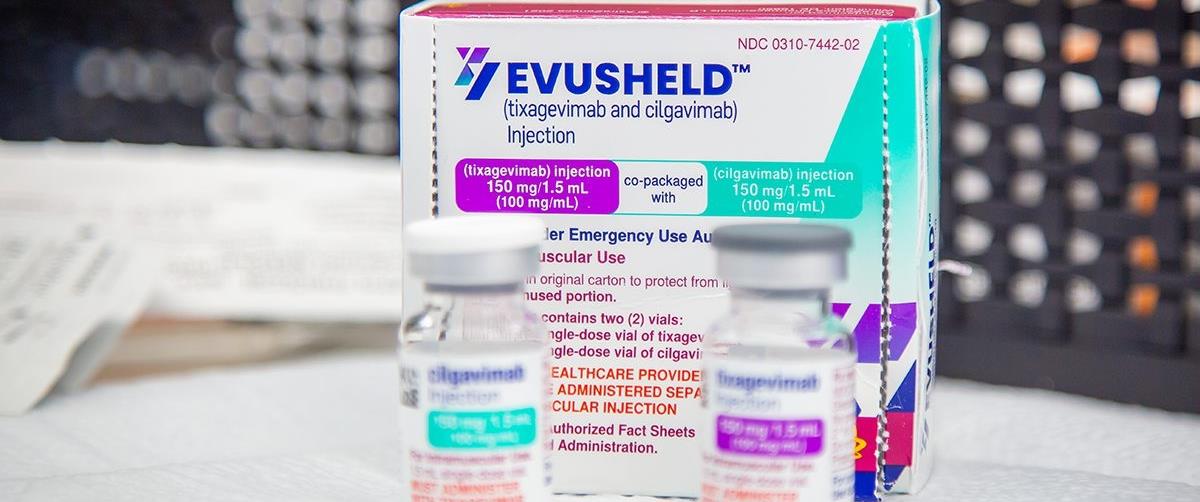
Η Επιτροπή του ΕΜΑ για τα φάρμακα ανθρώπινης χρήσης (CHMP) συνέστησε τη χορήγηση άδειας κυκλοφορίας για το Evusheld, το οποίο αναπτύχθηκε από την AstraZeneca AB, για την πρόληψη της νόσου COVID-19 σε ενήλικες και εφήβους ηλικίας 12 ετών και άνω και με βάρος τουλάχιστον 40kg πριν από την πιθανή έκθεση στον ιό SARS-CoV-2.
Το Evusheld αποτελείται από τις δραστικές ουσίες tixagevimab και cilgavimab, δύο μονοκλωνικά αντισώματα που έχουν σχεδιαστεί για να προσκολλώνται στην πρωτεΐνη ακίδα του ιού SARS-CoV-2 (ο ιός που προκαλεί τη νόσο COVID-19) σε δύο διαφορετικά σημεία. Όταν τα αντισώματα του Evusheld προσκολλώνται στην πρωτεΐνη ακίδα, ο ιός δεν μπορεί να εισέλθει στα κύτταρα για να πολλαπλασιαστεί και δεν μπορεί να προκαλέσει τη νόσο COVID-19.
Για να καταλήξει στο συμπέρασμά της η CHMP αξιολόγησε δεδομένα από μια μελέτη σε περισσότερα από 5.000 άτομα, η οποία έδειξε ότι το Evusheld, χορηγούμενο ως δύο ενέσεις των 150mg tixagevimab και 150mg cilgavimab, μείωσε τον κίνδυνο λοίμωξης από τη νόσο COVID-19 κατά 77%, με τη διάρκεια προστασίας από τον ιό να εκτιμάται σε τουλάχιστον για έξι μήνες. Στη μελέτη, ενήλικες που δεν είχαν ποτέ προσβληθεί από τη νόσο COVID-19 και δεν είχαν λάβει εμβόλιο έναντι της νόσου COVID-19 ή άλλη προληπτική θεραπεία έλαβαν το Evusheld ή εικονικό φάρμακο (εικονική ένεση). Από τα άτομα που έλαβαν το Evusheld, το 0,2% (8 από τα 3.441) παρουσίασε εργαστηριακά επιβεβαιωμένη λοίμωξη με τη νόσο COVID-19 τους πρώτους έξι μήνες έπειτα από τη θεραπεία, σε σύγκριση με το 1,0% (17 από τα 1.731) των ατόμων που έλαβαν εικονικό φάρμακο.
Το προφίλ ασφάλειας του Evusheld ήταν ευνοϊκό και οι ανεπιθύμητες ενέργειες ήταν γενικά ήπιες, με μικρό αριθμό ατόμων να αναφέρουν αντιδράσεις στο σημείο της ένεσης ή υπερευαισθησία. Η CHMP κατέληξε στο συμπέρασμα ότι τα οφέλη του φαρμάκου υπερτερούν των κινδύνων για την εγκεκριμένη του χρήση και θα αποστείλει τώρα τη σχετική γνωμοδότηση της στην Ευρωπαϊκή Επιτροπή για λήψη ταχείας απόφασης με ισχύ σε όλα τα κράτη μέλη της ΕΕ.
Τα δεδομένα της μελέτης συλλέχθηκαν πριν από την εμφάνιση της παραλλαγής Omicron η οποία επί του παρόντος προκαλεί τις πλείστες λοιμώξεις της νόσου COVID-19 παγκοσμίως. Εργαστηριακές μελέτες δείχνουν ότι η παραλλαγή Omicron BA.1 μπορεί να είναι λιγότερο ευαίσθητη στο tixagevimab και το cilgavimab στις δόσεις των 150mg από την παραλλαγή Omicron BA.2. Ο EMA θα μελετήσει δεδομένα τις προσεχείς εβδομάδες για να αξιολογήσει εάν ένα εναλλακτικό δοσολογικό σχήμα θα μπορούσε να είναι κατάλληλο για την πρόληψη της νόσου COVID-19 που προκύπτει από αναδυόμενες παραλλαγές.
Πού θα βρείτε περισσότερες πληροφορίες
Οι πληροφορίες προϊόντος για το Evusheld περιέχουν πληροφορίες προς επαγγελματίες υγείας, φύλλο οδηγιών χρήσης για το κοινό και λεπτομέρειες σχετικά με τους όρους αδειοδότησης του φαρμάκου.
Η έκθεση αξιολόγησης με λεπτομέρειες σχετικά με την αξιολόγηση του Evusheld από τον EMA και το πλήρες σχέδιο διαχείρισης κινδύνου θα δημοσιευθεί σύντομα. Τα δεδομένα κλινικών δοκιμών που έχουν υποβληθεί από την εταιρεία στα πλαίσια της αίτησης για άδεια κυκλοφορίας θα δημοσιευτούν στον ιστότοπο κλινικών δεδομένων του Οργανισμού σε εύθετο χρόνο.
Περισσότερες πληροφορίες θα διατίθενται επίσης σε μια ανασκόπηση του φαρμάκου σε απλή γλώσσα, συμπεριλαμβανομένης της περιγραφής των οφέλων και των κινδύνων του φαρμάκου καθώς και γιατί ο EMA συνέστησε την αδειοδότησή του στην ΕΕ.
Αξιολόγηση του Evusheld
Κατά την αξιολόγηση του Evusheld, η CHMP έτυχε της στήριξης της Επιτροπής για την ασφάλεια του EMA, PRAC, η οποία αξιολόγησε το σχέδιο διαχείρισης κινδύνου του Evusheld, καθώς επίσης και της ομάδας εργασίας για την πανδημία του COVID-19 EMA (COVID-ETF), μια ομάδα που συγκεντρώνει εμπειρογνώμονες από όλη το ευρωπαϊκό ρυθμιστικό δίκτυο φαρμάκων για τη διευκόλυνση της ταχείας και συντονισμένης ρυθμιστικής δράσης για τα φάρμακα και τα εμβόλια έναντι της νόσου COVID-19.
Το Evusheld αξιολογήθηκε ως μέρος της «OPEN», μιας πρωτοβουλίας που ξεκίνησε τον Δεκέμβριο του 2020 με στόχο την ενίσχυση της διεθνούς συνεργασίας κατά την αξιολόγηση, σε επίπεδο ΕΕ, των εμβολίων και των θεραπειών έναντι της νόσου COVID-19. Περισσότερες πληροφορίες είναι διαθέσιμες στην ιστοσελίδα του EMA για τη δακυβέρνηση κατά τη διάρκεια της πανδημίας COVID-19.